Berikut ini penjelasan tentang metode ilmiah, tahapan metode ilmiah, langkah langkah dalam metode ilmiah, urutan metode ilmiah, observasi, hasil pengamatan, eksperimen, pengukuran, besaran pokok, besaran turunan, tabel besaran turunan, tabel besaran pokok, tabel besaran pokok dan besaran turunan, sistem satuan internasional.
Langkah-Langkah dan Tahapan Metode Ilmiah
llmu Kimia dibangun dan dikembangkan melalui kajian teoritis dan kajian empiris yang saling mendukung satu sama lain. Pengkajian teoritis merupakan usaha menerapkan hukum-hukum Fisika dan teori Matematika untuk mengungkapkan gejala alam.
Pengkajian secara empiris merupakan usaha untuk menemukan keteraturan berdasarkan fakta yang ditemukan di alam dengan menggunakan teknik atau metode ilmiah. Pengembangan ilmu Kimia berdasarkan langkah-langkah sistematis disebut dengan metode ilmiah.
Metode ilmiah adalah metode sains yang menggunakan langkah-langkah ilmiah dan rasional untuk mengungkapkan suatu permasalahan yang muncul dalam pikiran kita. Dalam bentuk yang paling sederhana, metode ilmiah terdiri atas tahap-tahap operasional berikut.
1. Pengamatan atau Observasi
Pengamatan dapat dilakukan secara kualitatif (misalnya logam raksa berwujud cair pada suhu kamar) ataupun kuantitatif (misalnya tekanan gas pada keadaan standar yaitu sebesar 1 atm). Pengamatan kuantitatif disebut juga pengukuran.
2. Mencari Pola Hasil Pengamatan
Proses ini sering melahirkan rumusan berupa hukum alam. Hukum alam yang digali oleh manusia merupakan suatu pernyataan yang mengungkapkan perilaku umum suatu objek atau gejala yang diamati.
3. Perumusan Teori
Suatu teori (disebut juga model) terdiri atas sejumlah asumsi sebagai pijakan untuk menerangkan perilaku materi yang diamati. Jika hipotesis sementara sejalan dengan kajian-kajian sejumlah percobaan maka hipotesis tersebut disebut teori atau model.
4. Pengujian Teori
Secara ideal, teori dalam ilmu pengetahuan alam harus selalu dikoreksi dan dikaji terus-menerus sebab teori merupakan gagasan manusia untuk menerangkan perilaku alam yang diamati berdasarkan pengalamannya.
Teori harus terus disempurnakan melalui percobaan dengan cara menyempurnakan baik metode maupun peralatan yang digunakan. Di samping itu, dapat juga dilakukan melalui simulasi komputer, agar pendekatan yang diterapkan lebih mendekati gejala alam yang sebenarnya.
Eksperimen dan Pengukuran
Kimia merupakan ilmu pengetahuan yang dilandasi berbagai eksperimen/ percobaan. Salah satu syarat suatu eksperimen dinyatakan valid adalah bersifat reproducible (menghasilkan hasil yang sama ketika eksperimen dilakukan kembali).
Oleh karena itu, sangatlah penting untuk mendeskripsikan objek percobaan secara menyeluruh, seperti jumlah, volume, suhu, tekanan, dan kondisi lainnya. Dengan kata lain, salah satu hal terpenting dalam ilmu Kimia adalah mengetahui cara mengukur sesuatu dengan tepat.
Untuk keperluan tersebut, pada 1960, ilmuwan dari seluruh penjuru dunia berkumpul dan menyepakati penggunaan Sistem Satuan Internasional (dilambangkan SI, dari bahasa Prancis Syteme Internationale d’Unites).
Sistem satuan internasional memiliki tujuh besaran pokok (Tabel A) dan besaran-besaran lainnya yang diturunkan dari ketujuh besaran pokok tersebut (Tabel B). Berikut ini tabel besaran pokok dan besaran turunan menurut SI.
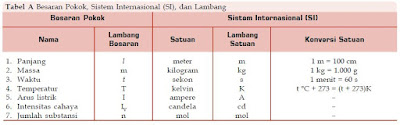 |
| Tabel A, Besaran Pokok, Sistem Internasional (SI) dan Lambang |
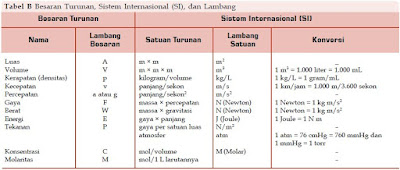 |
| Tabel B, Besaran Turunan, Sistem Internasional (SI) dan Lambang |
Dalam penulisan satuan suatu pengukuran, dilakukan penyingkatan (lihat Tabel A). Tanda eksponensial dicantumkan untuk menunjukkan pangkat dari satuan tersebut.
Sebagai contoh, kecepatan adalah panjang dibagi waktu yang dalam SI dinyatakan dalam meter per detik, atau m/s. Beberapa satuan turunan yang sering digunakan memiliki nama khusus. Misalnya, energi adalah hasil perkalian antara massa dan kuadrat kecepatan.
Untuk itu, energi diukur dalam satuan kilogram meter kuadrat per detik kuadrat (kg m2/s2), dan 1 kg m2/s2 disebut satu joule. Contoh lainnya, konsentrasi larutan (molaritas) adalah hasil perbandingan jumlah molekul dengan volume larutan.
Untuk itu, konsentrasi diukur dalam satuan mol per liter (mol/L), dan 1 mol/L disebut satu molar. Meskipun terdapat notasinotasi pendek untuk satuan-satuan tersebut, ada baiknya jika Anda juga dapat mengingat faktor konversinya.







