Berikut ini akan dijebarkan materi tentang konfigurasi elektron, struktur atom, bilangan kuantum, elektron valensi, tabel konfigurasi elektron, aturan hund, aturan aufbau, konfigurasi atom, larangan pauli, susunan atom, konfigurasi elektron ion, konfigurasi, notasi atom, konfigurasi elektron aufbau, urutan konfigurasi elektron, asas aufbau, jumlah atom, susunan elektron, struktur elektron, sifat elektron, susunan konfigurasi elektron, konfigurasi elektron unsur, daftar konfigurasi elektron, hubungan konfigurasi elektron dengan sistem periodik, tabel konfigurasi elektron atom, kimia konfigurasi elektron.
Konfigurasi Elektron
Konfigurasi elektron menggambarkan susunan elektron dalam orbital-orbital atom.
Dengan mengetahui konfigurasi elektron, jumlah elektron pada kulit terluar dapat ditentukan. Banyaknya jumlah elektron terluar dari suatu atom menentukan sifat-sifat kimia suatu unsur. Beberapa kaidah yang harus diketahui dalam penentuan konfigurasi elektron yaitu:
a. Prinsip Aufbau
Pada uraian sebelumnya, telah diketahui bahwa elektron menempati kulit atom berdasarkan tingkat energinya. Dengan demikian, pengisian elektron dimulai dari tingkat energi terendah menuju tingkat energi yang lebih tinggi.
Prinsip ini dikenal dengan prinsip Aufbau. Keadaan ketika elektron mengisi kulit dengan energi terendah disebut keadaan dasar (ground state). Urutan pengisian elektron dapat kalian perhatikan pada Gambar berikut ini.
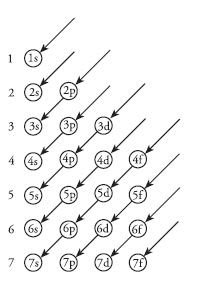 |
| Urutan tingkat energi pada orbital |
Urutan orbital berdasarkan tingkat energi mengacu pada urutan arah panah, yaitu 1s, 2s, 2p, 3s, 3p, dan seterusnya.
Dari urutan tersebut terlihat bahwa tingkat energi 3d lebih besar dibandingkan tingkat energi 4s. Jadi, setelah 3p penuh, elektron akan mengisi subkulit 4s terlebih dahulu sebelum subkulit 3d.
Pada saat pengisian elektron, subkulit dengan tingkat energi terndah diisi penuh terlebuh dahulu, kemudian sisa elektron akan menempati subkulit dengan tingkat energi lebih tinggi.
Misalnya, pada atom hidrogen, elektron terletak pada subkulit 1s. Jadi, orbital ini mempunyai satu elektron, maka kita tulis 1s1 untuk menunjukkan konfigurasi elektron atom hidrogen.
Bagaimana penerapan prinsip Aufbau dalam soal? Perhatikan contoh soal berikut.
Contoh:
b. Aturan Hund
Hund menyatakan bahwa elektron yang mengisi subkulit dengan jumlah orbital lebih dari satu akan tersebar pada orbital yang mempunyai kesamaan energi (equal-energy orbital) dengan arah putaran (spin) yang sama.
Subkulit yang mengandung orbital lebih dari satu adalah orbital p, d, dan f. pengisian elektron menurut aturan Hund dimulai dengan mengisi satu elektron pada tiap-tiap orbital dengan arah putaran (spin) yang sama.
Setelah semua orbital terisi satu elektron, elektron sisanya akan mengisi orbital dengan arah putaran (spin) yang berlawanan, sehingga orbital terisi pasangan elektron. Perhatikan contoh soal berikut.
Contoh:
Konfigurasi elektron Cr menurut aturan Hund berbeda dengan konfigurasi elektron hasil percobaan. Berdasarkan percobaan, konfigurasi 24Cr = (Ar) 3d5 4s1 sehingga diagram orbitalnya adalah:
Ternyata, subkulit d lebih stabil pada keadaan tepat terisi penuh atau tepat setengah penuh. Atom 24Cr lebih stabil dengan subkulit d terisi tepat setengah penuh.
c. Larangan Pauli
Pauli menyatakan bahwa tidak ada dua elektron dalam satu atom yang mempunyai keempat bilangan kuantum sama. Pernyataan tersebut dikenal dengan larangan Pauli.
Jika ada 2 elektron mempunyai nilai n,l , dan m sama, maka nilai s-nya harus berbeda. Pasangan elektron dalam satu orbital dinyatakan dengan diagram orbital berikut.
Karena satu orbital hanya ditempati 2 elektron, maka 2 elektron tersebut dibedakan berdasarkan arah putaran (spin) yang berbeda atau dapat dinyatakan bahwa elektron itu mempunyai bilangan kuantum spin berbeda. Perhatikan contoh soal berikut.
Contoh:
Penulisan konfigurasi elektron atom Ti (i) berdasarkan prinsip Aufbau, yaitu pengisian orbital dimulai dari tingkat energi terendah menuju tingkat energi yang lebih tinggi.
Penulisan konfigurasi (ii) ditulis dengan mengurutkan orbital-orbital pada subkulit terendah diikuti dengan orbitalorbital subkulit berikutnya.
Penulisan konfigurasi (iii) disingkat dengan menggunakan konfigurasi elektron gas mulia yang stabil.
Penulisan konfigurasi elektron atom (i) berdasarkan prinsip Aufbau.
Penulisan konfigurasi (ii) disingkat dengan menggunakan konfigurasi elektron gas mulia yang stabil.
Penulisan konfigurasi elektron atom (i) berdasarkan prinsip Aufbau, tetapi terdapat penyimpangan berdasarkan percobaan, yaitu pe ngisian elektron pada subkulit d yang tepat terisi penuh atau tepat setengah penuh lebih stabil, sehingga konfigurasinya (ii).







