Berikut ini artikel pembahasan mengenai perkembangan teori atom, teori atom dalton, a new system of chemical philosophy, kelebihan dan kelemahan teori atom dalton, model atom thomson, kelebihan dan kelemahan model atom thomson, model atom rutherford, kelebihan dan kelemahan teori atom rutherford, model atom bohr, teori kuantum planck, kelebihan dan kelemahan model atom bohr.
Perkembangan Teori Atom
Percobaan untuk menemukan jawaban atas pertanyaan “Apakah atom itu?” dilakukan seolah tiada henti. Aristoteles dan Demokritus menyatakan bahwa atom merupakan bagian terkecil dari suatu zat. Mereka menamakannya sebagai atomos. Kemudian, muncul teori John Dalton hingga Niels Bohr.
Mari, melihat kembali sejarah yang mengungkap fakta-fakta tentang teori atom.
1. Teori Atom Dalton
Pada 1808, ilmuwan berkebangsaan Inggris, John Dalton, mengemukakan teorinya tentang materi atom yang dipublikasikan dalam A New System of Chemical Philosophy. Berdasarkan penelitian dan hasil-hasil perbandingannya, Dalton menyimpulkan sebagai berikut.
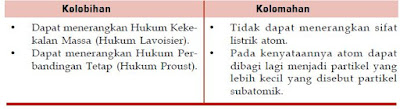
- Materi terdiri atas atom yang tidak dapat dibagi lagi.
- Semua atom dari unsur kimia tertentu memiliki massa dan sifat yang sama.
- Unsur kimia yang berbeda akan memiliki jenis atom yang berbeda.
- Selama reaksi kimia, atom-atom hanya dapat bergabung atau dipecah menjadi atom-atom yang terpisah, tetapi atom tidak dapat dihancurkan dan tidak dapat diubah selama reaksi kimia tersebut.
- Suatu senyawa terbentuk dari unsur-unsurnya melalui penggabungan atom tidak sejenis dengan perbandingan yang sederhana.
Beberapa kelebihan dan kelemahan dari teori atom Dalton, dapat dilihat dalam tabel berikut.
 |
| Tabel. Kelebihan dan Kelemahan Teori Atom Dalton |
2. Model Atom Thomson
Seorang fisikawan Inggris, Joseph John Thomson, pada 1897 menemukan elektron, suatu partikel bermuatan negatif yang lebih ringan daripada atom. Dia memperlihatkan bahwa elektron merupakan partikel subatomik.
 |
| Model Atom Thomson |
Dari penemuannya ini, J. J. Thomson mengemukakan dugaan (hipotesis) sebagai berikut: “karena elektron bermuatan negatif, sedangkan atom bermuatan listrik netral maka haruslah ada muatan listrik positif yang mengimbangi muatan elektron dalam atom”. Maka ia mengusulkan suatu model atom yang dikenal dengan model atom roti kismis sebagai berikut.
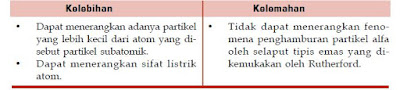
- Atom berbentuk bola pejal bermuatan positif yang homogen (diibaratkan sebagai roti).
- Elektron bermuatan negatif tersebar di dalamnya (seperti kismis yang tersebar di dalam roti).
Beberapa kelebihan dan kelemahan dari model atom Thomson, dapat dilihat seperti dalam tabel berikut.
 |
| Kelebihan dan Kelemahan Model Atom Thomson |
3. Model Atom Rutherford
Ahli fisika Inggris, Ernest Rutherford beserta temannya Geiger dan Marsden pada 1911 melakukan eksperimen yang dikenal dengan penghamburan partikel alfa oleh selaput tipis emas (0,0004 mm). Setelah berkali-kali melakukan percobaan, akhirnya Rutherford berhasil mengungkapkan fakta-fakta berikut.
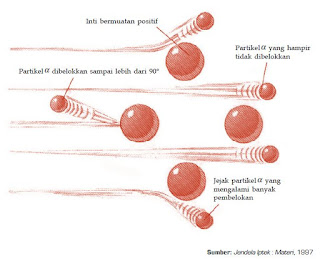 |
| Percobaan Penghamburan Partikel Alfa oleh Selaput Tipis Emas |
- Sebagian besar partikel alfa menembus selaput tipis emas. Berarti, sebagian besar atom adalah ruang kosong.
- Sedikit dari partikel alfa (yang bermuatan positif) dibelokkan keluar oleh sesuatu, hal ini menunjukkan adanya sesuatu yang bermuatan positif yang dapat membelokkan partikel alfa.
- Lebih sedikit lagi dari partikel alfa itu (hanya 1 dari 20.000) terpantul dari selaput tipis emas. Dengan kenyataan ini, Rutherford sempat tercengang dan berkomentar, “sungguh luar biasa, seolah Anda menembak selembar kertas tisu dengan peluru setebal 40 cm dan peluru itu kembali menghantam Anda sendiri”. Hal ini menunjukkan adanya sesuatu yang sangat kecil (belakangan disebut sebagai inti), namun massa terpusat di sana sehingga partikel alfa yang menumbuk pusat massa itu akan terpantulkan.
Dari fenomena percobaan tersebut maka Rutherford mengusulkan suatu model atom yang dikenal dengan model atom nuklir Rutherford sebagai berikut.
- Sebagian besar ruangan dalam atom merupakan ruangan kosong.
- Atom terdiri atas inti atom bermuatan positif dan hampir seluruh massa atom terpusat pada inti.
- Elektron beredar mengelilingi inti.
- Jumlah muatan inti sama dengan jumlah muatan elektron sehingga atom bersifat netral.
Akan tetapi, teori atom Rutherford juga memiliki kelemahan. Beberapa kelebihan dan kelemahan dari model atom nuklir Rutherford, dapat dilihat seperti dalam tabel berikut.
 |
| Tabel. Kelebihan dan Kelemahan model atom Rutherford |
4. Model Atom Bohr
Niels Henrik David Bohr adalah seorang ahli fisika Denmark. Pada 1913, Bohr mengemukakan teori tentang atom yang bertitik tolak dari model atom nuklir Rutherford dan teori kuantum Planck.
 |
| Model Atom Bohr |
Model atom Bohr berdasarkan teorinya sebagai berikut.
- 1. Elektron beredar mengelilingi inti pada lintasan-lintasan (orbit) tertentu.
- 2. Elektron yang beredar pada lintasannya tidak memancarkan energi, lintasan elektron ini disebut lintasan stasioner.
- 3. Apabila elektron dengan tingkat energi rendah pindah ke lintasan dengan tingkat energi lebih tinggi maka elektron akan menyerap energi, peristiwa ini disebut eksitasi. Sebaliknya, apabila elektron pindah dari lintasan dengan tingkat energi lebih tinggi ke lintasan dengan tingkat energi lebih rendah maka elektron akan memancarkan energi, peristiwa ini disebut deeksitasi. Baik eksitasi maupun deeksitasi disebut peristiwa transisi elektron. Energi yang diserap atau dipancarkan pada peristiwa transisi elektron ini dinyatakan dengan persamaan:
- 4. Energi yang dipancarkan/diserap ketika terjadi transisi elektron terekam sebagai spektrum atom.
Beberapa kelebihan dan kelemahan dari model atom Bohr, dapat dilihat dalam tabel berikut.
 |
| Kelebihan dan Kelemahan Model Atom Bohr |







